|
直肠癌手术操作改进及新的手术方法
1.腹会阴联合切除操作的改进
⑴腹会阴造口术:为减少造口旁疝等并发症,可应用腹膜外造口术,手术方法见图1~4。
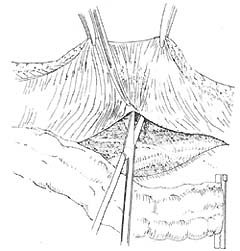
图1 左下腹造口已戳孔于膜横筋膜
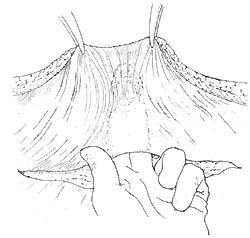
图2 继续游离后腹膜
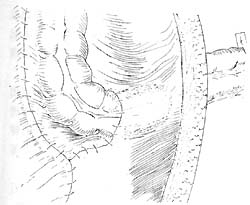
图3 腹膜造口术已完成
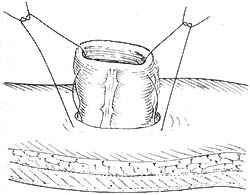
图4 造口从腹膜外引出后,将多余结肠切除,结肠与皮肤间断缝合
⑵会阴部切口处理:以往会阴部切口术后应用纱布堵塞,术后换药肉芽填充,二期愈合。现一期缝合,骶前置放引流物,一般放置两条,各自从切口两侧引出图5(也可均从一侧引出)。
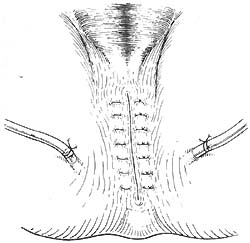
图5 骶前置放引流物,一般放置二条,各自从切口侧引出(也可从切口一侧引出)
2.会阴部结肠造口手术 距肛管5.5cm以下直肠下段癌,原则上作腹会队联合切除术后,腹部永久性人工造口,但彻底根除直肠癌后,符合会阴部重建肛门指征者,可挑选肛旁肌肉移植,肠段套叠式或外翻式重建人工肛门,此类手术在国内近10余年来有很大进展。
重建肛管括约肌应用肛旁及附近臀大肌及股薄肌作为重建术材料,Chestwood(1902)及Chitteden(1930)普应用臀大肌作为重建材料Pickrell(1954~1955)应用股薄肌重建先天性肛门失禁,预防感染,注意结肠血液供应是手术成功的关键。其余31例术后都建立了较好的肛门功能。
Hallan(1990)在动物实验基础上应用于临床,利用电刺激控制会阴部人工造口,控制排。在会阴部人工造口后,在移植之股薄肌内安置电刺激器可定期开放控制排便。手术分二期进行,第一期癌肿切除后,结肠与肛缘皮肤缝合(图6)。第二期,移植股薄肌,安置电刺激器。电刺激器安装在支配股薄肌的神经束上。图7、8说明电线从股部引到左腹壁并安置于皮下。
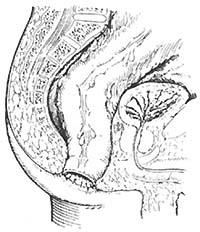
图6 癌肿切除后,结肠与肛缘皮肤缝合
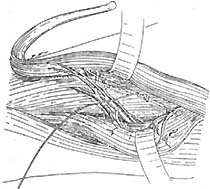
图7 移植股薄有,安置电刺激器
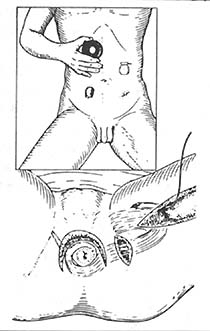
图8 电刺激安装在支配股薄肌的神经束上,电线上从腹部引到左腹壁并安置于皮下
上海仁济医院自1983~1993年,对44例肛管直肠下段恶性肿瘤采用经腹会阴联合切除,会阴部肠造口,带蒂臀大肌肛管括约肌成形术经随访结果疗效良好。此手术在原肛门切口处将近段结肠拉出,应用带蒂臀大肌围绕结肠一圈做成功括约功能的肌束,收缩肌束时能闭合肛管。手术分二期进行。
第一期:经腹会阴联合切除后,结肠拖出带蒂臀大肌重建肛管括约肌。手术分3步进行:
①经腹会阴联合切除术;
②游离带蒂的臀大肌通过皮下引至肛周;
③结肠拖出用带蒂臀大肌重建肛管括约肌。
第一步:连续硬膜下麻醉下,取膀胱截石位,按腹会阴联合切除术要求常规根治癌肿,但尚需注意近端结肠的长度和良好血液供应,在肠系膜下动脉近起点处分别结扎切断肠系膜下动脉分横结肠,游离降结肠直至结肠脾曲或至部分横结肠,近端结肠及其系膜在无张力情况下,以肛门创口处拖出,距肛缘皮肤至少2cm以上。
第二步:用消毒敷料保护腹部及会阴部切口后,取左侧或右侧卧位,暴露一侧臀部及大腿外侧,常规消毒皮肤铺巾,在严格无菌操作下进行,在坐骨结节上3cm,股骨大粗隆下3cm向股外侧肌中上1/3处作“L”形切口(图9),切开皮下组织暴露臀大肌肌腹,在臀大肌肌腹下缘分离约4cm宽的臀大肌束远端到臀大肌下端附着于股骨臀肌粗隆处及大臀大肌止点处与此肌相连的部分股外侧肌共约20mm(图10),切断股外侧肌远端,然后向近心端分离股外侧股肌束臀大肌,注意保护伸向臀大肌的滋养血管及神经束,同时避免损伤坐肌神经,将游离臀大肌和股外侧肌通过皮下隧道引至会阴部切口的备用代括约肌(图11)。
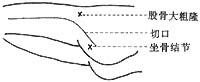
图9 左侧卧位,在坐骨结节上3cm,股骨大粗隆下3cm,向股外侧肌中下1/3处作“L”形切口
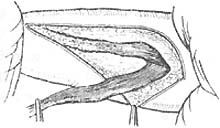
图10 已分离出臀大肌和与此机相连的部分股外侧股长约20cm
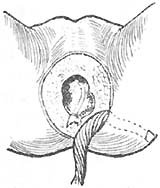
图11 游离臀大肌和股外侧肌通过皮下隧道至会阴部切口拖出
第三步:取膀胱截石位,按逆时针方向将臀大肌肌瓣环绕结肠下端一圈,肛管口通过一食指之紧张度为适且,然后将臀大肌瓣固定缝合于坐肌结节骨膜及残剩肛提肌边缘(图12)。
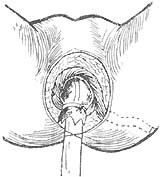
图12 臀大肌通过皮下隧道绕结肠一圈,下端结肠插入肛管,用丝线扎紧固定
第二期:第一期手术后2~3周会阴部创面基本愈合即可进行肛管成形术手术。取膀胱截石位,切除拖出皮面外多余结肠段,可应用整形手术将皮肤与肠段三角形(图13)或Z形缝合重建肛门。
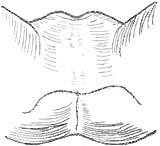
图13 转移三角形皮瓣形成的新肛管
44例患者无近期手术死亡,无严重感染,1例因重建肛门狭窄再次整形获愈,出院随访44例,随访率100%,随访期最长10年,最短6月,存活不满5年者10例,其中死于肿瘤复发者9例,死于其他疾病者1例(在精神疾病服药过量)排便功能各项批标检查优良率90%以上。
臀大肌是髋关节巨大伸肌,血供丰富肌束收缩力强,移植之肌束比正常之肛管括约肌测压时之收缩波高出1倍以上,手术取村较易掌握,有协调肛提肌收缩肌管作用,晚较理想的移植肌瓣,但欲转移至会阴部围绕结肠代括约肌,在某些病例中,长度不足,必须同时取一部分股外侧肌束。更主要是保留了臀大肌瓣的血管神经束,并因势利导地转移肌瓣,故仍是遵循了整形外科肌瓣转移原则。
随着对臀大肌解剖进一步了解,在不影响血供情况下能分离出较长的臀大肌束,因此近年来股外侧肌应用一般在3cm以内,此肌与臀大肌相接部有丰富侧支,术中检查一般血供均良好。
第二期肛门成形Z形皮瓣整形,创面较小,术后亦无肛周皮肤湿疹,及狭窄等现象。
要有满意的排便控制能力,除有肛管代括约肌可控制排便外,尚需有近端结肠储存功能及良好的感觉。我们对此手术的设计原理有以下几点认识:
①应用宽阔之臀大肌瓣,围绕结肠时如取右侧臀大肌瓣,则围绕时按逆时钟方向先缝合固定结肠并在前方将肌束固厚之臀骨弓下使结肠进入肌束时形成90º直角;
②在近端结肠部按正常肠瓣部位,横形褶叠缝合结肠,形成结肠内三瓣膜,从而对结砀蠕动和排粪反射直到一定对抗作用,配合代括约肌,末端结肠能起到贮藏袋作用。本组2例术后钡灌肠检查,末端结肠膨大类似直肠壶腹;
③多年来认为齿线部直肠壁内或耻骨直肠肌等肛提肌内具有感受器,承担着正常感觉,控制及排便能力。但本组44例均切除全部直肠,肛管括约肌和耻骨直肠肌,耻骨尾肌肌,但几乎全组病员仍能感受到结肠粪便充盈,保持肛管控制力的感受器可能位于残剩之肛提肌内,或结肠充盈时传导至移植的臀大肌内,抑或是骶神经,骨盆神经丛交叉感受而得,尚待进一步研究;
④正常人睡眠后,肛提肌和外括约肌松弛,内括约肌保持的张力,能防止夜间遗粪,带蒂臀大肌重建肛管括约肌,代替了随意肌作用,理论上,肛管内括约肌不能替代,因内括约肌是不随意肌,但随访中夜间遗粪现象仅5例,并在术后6个月调整饮食习惯,遗粪现象仅偶有出现,我们认为臀大肌虽是随意肌,但在围绕结肠一圈使结愮腔适度缩小容纳一指左右,并维持一定张力,可能也起到类似内括约肌作用。
本手术适用于①先天性或创伤性肛门失禁;②肛管直肠下段癌(距肛缘5.5cm以内无法保留肛管者)经腹会阴联合切除后不愿作腹部人工肛门者。由于再造肛管括约肌需积极进行功能锻炼,因此必需能与医师密切配合者。
禁忌证:
①年老体弱有严重器质性疾病患者一般不宜考虑;
②Dukes D期患者;
③盆腔部局部浸润严重,需作全盆腔或脏器扩大切除术,作本手术,需增加手术时间;
④术后需作放疗病例。Dukes C期患者,一般可考虑为相对禁忌证,因术后5年生存率低。本组术后5年内肿瘤复发死亡9例中,3例臀大肌成形术后发现肝及腹腔内转移,余6例均为Dukes C期病例。
造成代括约肌功能不佳的主要原因之一是严重感染,纤维化牵制移植肌瓣活动,又影响肛管皮肤敏感怀,因此术前必须严重执行肠道准备,术中执行无菌操作,术后加强切口护理工作,此外,尚须注意拖出肠段之血供情况,术时需保留边缘血管,不然肠段之血供情况,术时需保留边缘血管,不然肠段坏死导致严重切口感染。术后保护拖出肠段,勿使弯曲折叠,本组1例,术后肠段近肛缘处因坐卧时不慎,本组1例,术后肠段近肛缘处因坐卧时不慎,弯曲肠段,使肠壁受压坏死,应用第二期△形皮瓣纳入肛管治愈。
通过44例会阴部结肠造口臀大肌成形术,我们认为对年轻患者,无法保留肛管;尚属早中期的肛管直肠下段或坚决不愿作腹部人工肛门者,随意对成形术的技术操作熟练和改进,此手术不失为是一种可采用的技术。
本术式操作方便、简易,有宽阔带蒂血管神经束之臀大肌瓣,不但有随意肌作用,并具有类似内括约肌作用,缝合肌瓣时,悬吊向前形成肛直角,有类似耻角直肠肌功能,故术后短期内即有优良的排便控制功能。在术后随访病例中,即使是优良组病例,控制排便能力在腹泻时和正常人间尚存在着一定差距。正常人肛管括约肌收缩是轻而易举的动作,但在成形术病人中,必需用力不断操练,并在控制排便过程中需提早收缩肌瓣,否则效果适得其反,肌瓣管内大便在收缩时将快速排出。
3.管状吻合器的应用 1979年我国研制成功EEA管状吻合器,目前已在全国各大医院内应用,使困难的盆腔部吻合术得到解决,利用吻合器作Dixon手术,可避免作Black式,改良Bacon式和Park手术,因后者并发症多,需第二次手术,并要加作横结肠造口。然而剩余直肠短(小于2cm),骨盆狭小,过度肥胖的病人,在腹部即使应用吻合器也难完成吻合术。1980年,上海仁济医院利用管状吻合器,将结、直肠在拉出肛管部进行切除吻合术,克服了上述困难。有操作简便,创伤少、并发症少等优点。
手术方法:首先按Miles手术步骤顺序处理肠系膜下血管,切开游离乙状结肠,直肠系膜,铕按管状吻合器使用是注意点,钳夹降结肠下段,清洗和消毒肠腔,排尽肠内容物并切断该处肠段,近端肠段留置使用,然后从肛管部夹住直肠肠段外翻出肛门外(图14),如癌肿超过周径1/3者,则先切除癌肿(图15),否则不易外翻,并可引起挤压癌肿,造成转移。精确测量肿瘤下端长度,一般距癌肿4cm处切断直肠,最后将近远端肠管残端进行荷包缝合,近端肠段荷包缝线紧扎于中心杆上,通过肛门已外翻至远端直肠,所紧远端直肠荷包缝线(图16),调节间距后进行结肠、直肠吻合(图17)。
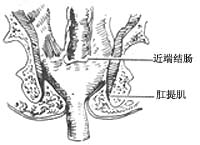
图14 直肠远端连同肿瘤组织外翻检出肛门外
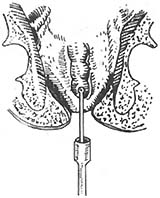
图15 近端肠段荷包缝线紧扎于中心杆上
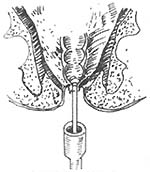
图16 远端肠段荷包缝线紧扎于中心杆上
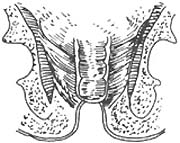
图17 应用吻合器完成结肠直肠吻合
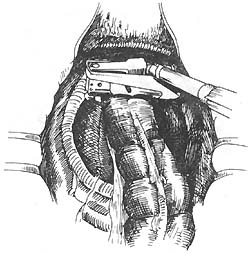
图18 应用钳闭器钳闭直肠残端
双吻合器的应用:上海仁济医院近年来应用国外一次性钛钉双吻合器,直肠下切端可不用荷缝合,应用钳闭器钳闭直肠残端(图18),近端应用荷包器缝合近端肠段边缘(图19),然后应用吻合器吻合(图20~23)。吻合口安全可靠。目前尚无并发症及手术死亡率,应用于下端直肠癌更提高了在腹腔内切除吻合率,唯一缺点是价格较昂贵推广困难。
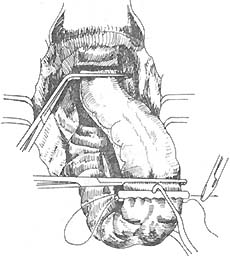
图19 近端应用荷包器缝合近端肠段边缘
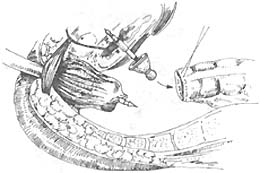
图20 应用吻合器吻合㈠
图21 应用吻合器吻合㈡
图22 应用吻合器吻合㈢
图23 应用吻合器吻合㈣
手术注意点:结直肠切除吻合术注意点与一般胃肠道相同外,因直肠下段缺乏浆膜,直、结肠血供较小肠差,粪便中细菌数量多,更需注意结肠手术前肠道准备工作,注意血供,吻合时粘膜对齐,勿使有张力。
注意事项:
①应用前,应常规检查EEA吻合器各部件是否正常完好,安装齐全正确;
②肠段周径应和肠吻合器口径相称,一般采用34号;一次性吻合器则采用31号或33号;
③游离肠段之近远端至少有1~2cm,清除系膜及脂肪垂,使吻合时两层肠管壁厚度均匀一致;
④二肠段需清洗,消毒,套入吻合器时,避免肠内容物外溢污染手术区;
⑤正确进行荷包缝合,是吻合成功之关键,荷包缝线应紧扎于中心杆上,并修剪外翻组织,缝线与切缘与距约3mm,缝合要用4或7号粗线以及防收紧结扎时断裂,结扎后,剪短缝线;
⑥间距调节适宜,根据正常人肠壁之厚度1~1.6mm,直肠1.6~2.5mm,调节间距为1.5~2mm比较适宜;
⑦吻合时钉合钳夹操作正确可靠,扳动吻合器手柄,必须一次到底,术者常有切割断落感,如若扳动不力或多次扳动,缝钉成表不全或切割不全,影响吻合效果;
⑧完善之吻合,逆时钟转动尾端调节螺丝后,吻合器退出应无困难,否则,可先退出器身,然后轻牵中杆,并作倾斜摆动,如有困难,需在直视下,切开该部牵连处用丝线加固缝合;
⑨吻合后应检查切下之近远端,拆除缝线的全层是否完成圈状,如有缺损则表示该处缝合不全;并直视检查该处肠壁是否仙翻,完整,在直肠低位吻合时,可通过肛检,轻扪吻合处内翻边缘情况,同时观察有否出现现象;
⑩吻合口必须无张力,否则缝钉切割组织易致吻合口瘘。
㈤术式选择
1.直肠下端癌(距肛管直肠环2cm以下)一般作不保留肛门的腹会阴联合切除术,切除范围广,根治效果较好,但永久性腹部人工造口是其缺点。
2.直肠上端癌(距肛管直肠环4cm以上)道选为直肠前切除术,能较好地保持正常排便功能。
3.直肠中段癌(距肛管直肠环2~4cm)采用哪种手术方式意见不一,有推荐保留肛门的拉出术(Bacons术),由于对此种手术疗效评价不同,及并发症的产生,应用不甚普遍,不少患者选作Miles术,从50年代起,对直肠癌壁内浸润及淋巴引流的重新认识和研究,修正了Miles提出不论直肠癌的部位,其肠壁外和淋巴扩散都有向上、向两侧和向下三个途径转移的观点,现认为直肠癌在腹膜反折平面以上的癌主要向上扩散,只有高度恶性癌或晚期癌,当向上淋巴引流途径被癌肿浸润阻塞时,才向下逆行扩散。腹膜反折以下的癌向上,同时也向侧方、下方扩散,但肠壁和淋巴结扩散距离一般在2.5cm以下,因此,直肠下肠癌在手术时,将直肠自肛提肌水平处全部游离后,延伸了远端直肠的长度,因其近端和两侧切除范围与进行Miles的术式相同,如适当保留直肠远端,则扩大了保代手术的适应范围,手术彻底性又不亚于腹会阴联合切除,因此直肠下段癌手术方式需综合考虑其部位、大小、形成、浸润范围、深度、组织类型及距肛管状吻合器经用前切除术,但剩余直肠过短,骨盆狭小,过度肥胖的患者,在腹部,即使应用吻合器也难完成吻合术,可利用管状吻合器,将结、直肠在肛管部进行切除吻合术,此法并发症少,并有创伤小操作尚简便的优点,如手术吻合失败可改用Black法,第二期手术时,不用吻合。在远端直肠更短或全部切除时,可适用改良Bacon,Ravitch方法。保存肛管括约肌功能较Bacon法好。Welch法及Park法,中能一期作结肠肛管吻合术,但易引起吻合瘘,有时需考虑加作横结肠造口。后方经骶骨部或经腹经骶骨径路作直肠癌切除吻合术,手术野范围狭小,易感染及瘘。前方经耻骨径路适用于直肠浸润范围较大者,但手术操作仍较复杂。目前如经济条件许可,应用钛钉双吻合器,操作方便,吻合口安全度高,可作保肛肛首选方法。
综上所述,术式选用,除已公认为理想的手术方法外,尚须按术者对手术方式习惯处理和熟练程度而定。
|




