|
会阴部人工肛门重建术术式
一、腹会阴联合切除术:
腹会阴联合切除术,又称Miles(1908)手术。该术式是目前治疗乙状结肠下段、直肠和肛门部恶性肿瘤的标准术式。其特点是治愈率最高,死亡率最低。手术步骤如下:
1.术前准备:在连续硬脊膜外麻醉下,取截石位,腹部、会阴部术野区域皮肤常规消毒,铺无菌手术单,置导尿管,双层荷包缝闭肛门。作下用正中切口或左下腹经腹直肌切口。
2.探查:进入腹腔后首先检查肝、腹主动脉旁和乙状结肠系膜淋巴结,探查直肠膀胱陷窝等处有无转移情况。其次是检查结肠的其他部位,以除外有无多发性癌或其他良性病变存在。最后检查癌肿,确定其位置、大小及其与附近器官的关系。如肿瘤已经固定,应放弃切除的企图而考虑作结肠造口。
3.游离乙状结肠:经过探查确定可进行切除后,可将手术台调节到头低脚高位,使小肠移位到上腹,以便盆腔能获得良好的暴露。先在距乙状结肠肠袢1~2cm处切开乙状结肠的左侧腹膜,进而将切口绕向乙状结肠的前面,切开直肠膀胱反折处或直肠阴道反折处的腹膜,现向上切开乙状内侧的腹膜。在解离此处腹膜时,注意避免损伤左右侧输尿管、精索或输卵管。提出乙状结肠,辨认痔上动脉、乙状结肠动脉和肠系膜下动脉的分支情况,并根据所见的肿大淋巴结的分布情况,决定血管应该结扎切断的部位。在一般情况下,肠系膜下血管的结扎在最高一支乙状结肠血管分支点之下,此处可使造口的肠袢获得较好的血液供应。
4.解剖直肠:肠系膜下血管结扎切断后,手术者即可用手伸到乙状结肠及其系膜之后面,沿骶骨凹钝性分离乙状结肠及直肠,直到尾骨尖为止。随即进行直肠前壁的解离,在男性,应解剖至膀胱底、精囊及前列腺;在女性,则解剖至子宫后面的子宫骶骨韧带和阴道,止于肛提肌平面。此时如将直肠上提,即可暴露其则壁的联系,其中包含痔中动脉,可用长弯血管钳钳夹、切断,并贯穿结扎此直肠侧壁组织,使整个直肠四周无游离于肛提肌的平面。
5.结甩的造口和盆腔腹膜、腹壁的缝闭:将已经游离的乙状结肠用两把挤压钳夹好后切断。切断的部位必须使近切端既有良好的血运,又有足够的长度,以便使其引出腹壁外造口。具体步骤是:先将远切端内翻埋藏在一个荷包缝线内,再用一只橡皮手套套住此切端后用粗线系紧,保证不致有污物自切端溢出;随即缝合盆腔腹膜,重建盆底。此后即可将结肠近切端引出腹壁外作人工肛门,并缝合腹壁。造口时应在脐与左髂骨上棘连线的外1/3处另作切口,将结肠近切端引出,且需将造口结肠袢与侧腹壁之间的腹膜沟缝闭,以免发生内疝。结肠引出忌扭曲,肠管外露皮肤应有4~5cm。腹壁各层组织的缝合用肠线,皮肤的缝合用丝线。缝合后可在肠管周围用凡士林纱布盖好,以防创口污染。
6.会阴部的切除;距肛门2~3cm处作椭圆形切口,将肛门提起,沿尾骨缘剪断括约肌的尾骨附着韧带,经钝性分离进入直肠后间隙中,将两侧肛提肌切断(此步后即可将乙状结肠切断和直肠倒拉出创口外),再将肛管和直肠下段与尿道、前列腺或阴道之间解离,将乙状结肠、直肠和肛管及其周围的皮肤和坐骨肛管窝中的脂肪组织,连同肛提肌是在的直肠组织一并切除。
会阴部创口的后部适当缝合几针,前面留一小切口放置引流管,至此手术完毕。
二、会阴部肛门重建术的类型:
近30年来,我国肛肠外科医务工作者开展了低位直肠癌切除肛门重建术方面的研究,取得了不少成就。60年代初,张庆荣首先报告了应用股薄肌移植重建肛门括约肌成形术的方法和治疗结果,引起了国内学者注意,继而又设计了许多接近或达到正常人排例自控疗效的肛门重建术式,为直肠癌患者带来生活与工作之便。我国学者经过不断努力与实践。创立或改进了不少有关术式和方法,现就几种主要的介绍如下。
1.股薄肌移植括约肌成形术:在1952年,Pickrell等首先采用移植带蒂股薄肌重建外括约肌治疗肛门失禁的患儿。通过的40年代的研究,国内外学者普遍认为肌薄肌是重建术中理想的替代括约肌的肌肉。Leguit(1985)和Mercatt(1991)通过肛门测压实验后证实,移植后的股薄肌在所形成的高压区域的范围及最大收缩力等方面均符合正常生理的要求。我国学者随访15年后发现移植后的股薄肌的血供和收缩力均正常。
在1956年,有人采用该种术式在我国首开会阴部再造肛门的先河。其方法是:当腹内手术的主要部分将要完成时,则将一侧股薄肌取出,即由一侧胫骨上部股薄肌止点处将它切断,由大腿皮下将股薄肌抽出,自股上部伤口拉出,以备移植。再开始会阴部手术。先在肿瘤上方,血液供给良好部分切断乙状结肠。将乙状结肠沿骶骨和尾骨前面下牵,并稍弯向前,至会阴部伤口前端,再弯向下曲成约90º角,作成肛管。然后修正乙状结肠断端,距离乙状结肠断端和伤口皮肤边缘2~3cm处,将乙状结肠浆膜与肛提肌缝合,周围用丝线缝合5~6针,于是围绕乙状结肠和外侧肛提肌及皮下组织之间,即开成一沟,以备移植股薄肌之用。由一侧胫骨粗隆内下部股薄肌止点将它切断,由大腿皮下将股薄肌取下,自股上部切口拉出,用盐水纱布垫包裹,以备移植。再半患者放于截石位,由股上部切口至会阴伤口前端。在皮下作一隧道,并在对侧腹股沟韧带内侧,开一节口,通过皮下至会阴伤口前端作一同样隧道,将股薄肌经皮下隧道由伤口前方拉出,在已作成的沟内,围绕乙状结肠,由前方到对侧,经过后方,到前方交叉,再通过对侧隧道,由腹肌沟切口将肌腱牵出,以备固定。
在股薄肌浅面,将乙状结肠浆膜与皮下组织缝合,周围缝合5~6针,使股薄肌固定于结肠周围,然后将结肠粘膜与皮肤缝合。这样在肛门原位作成以股薄肌代替肛门括约肌的肛门。在伤口后端尾骨骶骨前方放2~3条烟卷引流,缝合会阴部伤口。拉费用股薄肌腱,并可内收或外展下肢,确定肛门是滞够紧,一般用指摸肛门地,紧如子宫口即可,牵紧肌腱,固定于耻骨结节和腹股沟韧带上,最后缝合伤口。如作分期手术,将乙状结肠牵向下后,使乙状结肠由骶骨前方向下弯向前再向下,成90度角,并由伤口前方拉出作成肛管。修剪乙状结肠断端,将肠粘膜与皮肤缝合,缝合伤口,待伤口愈合去线后,再作股薄肌移植。分期手术当第一期手术去线后可作二期股江肌移植手术,不必等待会阴部伤口完全愈合。此时结肠末端与周围组织尚未粘连坚实,手术比较容易,也可缩短住院时间。一期手术,手术时移植股薄肌时更比较容易。虽延长一些手术时间,但便乙状结肠下端在作成肛管和移植肌肉时放于适当位置,比分期手术更为准确,效果满意。由临床近期疗效来看,肛门括约肌功能加强,估计近期效果可能更为满意。进普通饮食,不需灌肠。
有人(1963)对18例接受该术式的患者进行了分析,认为:移植股薄肌的肌束比括约肌的肌束粗大,收缩力强,故作用当比外括约肌更好。并用指出:感染是造成肛门功能不良或手术失败的主要原因。与此同时强调,手术缝合时,必须将结肠弯向前再向下作成角度,可加强肛门功能,也是这一手术的重要步骤。张庆荣将术后肛门功能的标准分为四类:①优良:排便功能与手术前相同;②好:能控制干便,不能控制稀便,有的病例需要灌肠来调理排便,不常带棉垫;③较好:粪便常污染衣裤,必需常带棉垫,或必须长期灌肠以维持排便功能;④不好:粪便不如不觉地随时外流,常用棉垫,必须依赖灌肠使直肠空虚,减少粪便外流。
有的学者指出移植后股薄肌缺血坏死、纤维化的发生经比较高,这就影响了该术式的无期效果。针对这种情况, Williams(1990)根据股薄肌的血供特点设计了延期术式,即在移植前4~6周离断其远端2~3支血管蒂,以期肌肉远端建立良好的侧枝循环后再行移植。这样在临床上较好地解决了约有25%移植后的股薄肌缺血坏死、瘢痕化的问题。
由于股薄肌是快收缩、易疲劳的肌肉,因此导致单纯移植股薄肌重建外括约肌再造的肛门功能不完善。近来的研究表明,连续低频刺激能使快收缩、易疲劳的肌肉转变为慢收缩、抗疲劳的肌肉。正是基于此,Williams(1990)利用植入性电极,刺激移植后的股薄肌,来改善再造肛门的功能。他在文献中写道:追踪发向股薄肌(等移植的)神经主干直至该肌肉的侧面,在这神经的主干及其分支上放置一块带有4个铂一铱电极的MR电极板。将电极调到整条肌肉收缩电位域值最低处(-2.0V,0.2ms/s)用20次/s,2.5V和0.21ms的刺激连续刺激移植后的股薄肌。现在引起强直性收缩的刺激频率是15次/s,压力平台可维持30分钟。在无括约肌收缩时灌注生理盐水34ml即开始泄漏。但当括约肌强直性收缩时,直至254ml才发生泄漏。融合频率的减低,压力平台时间的增加,灌注生理盐水容量的增加均表示从快收缩到慢收缩肌肉的转变已经开始,虽然物理试验已表示发生了这种转变,但是缺乏组织学及生化方面的证据。患者对干便控制良好,但对稀便却不能控制。很明显我们所重建的直肠和肛门括约肌是粗糙的,无法与复杂的、正常的肛门自制机理相比拟,由于失去了敏感的肛管粘膜,使患者丧失了肛管直肠所有正常的分辨能力,另外,我们的患者没有便意感,表明行腹会阴直肠切除时,存在于盆底肌肉或筋膜的感受器已被完全切除或破坏。但是,即使在现阶段我们仍相信这种术式为许多需要或者已接受腹会阴直肠切除术的患者提供了一种实用可选择的术式。该术式最终将使大多数患者不必再接触永久性腹壁造瘘术。
有的学者经过10多年潜心研究发明了股薄肌移植术整套手术器械。他根据股薄肌为大腿内侧中间最表浅的肌肉,上宽下窄,呈锥形,其周围交叉肌肉及肌腱的特点,设计出不损伤其他肌肉及股薄肌本身的股薄肌游离刀、与股薄肌肌腱粗细走向相配套的肌腱游离刀。根据3个不同结构的隧道的特点,设计出隧道板、肛门成形隧道器、隧道引针、剥离板、肌腱起刀、隧道探钩等共13件。此发明填补了我国在该项手术器械方面的空白,进一步提高了技术水平。
2.原位结肠套叠式人工肛门术:随着人们对肛门自制机理的研究不断深入,肛门内括约肌在肛门自制中所起的作用日益得到了重视,但由于人们在研究内括约肌生理特性时遇到了许多困难,所到直到80年代初期,内括约肌重建术才陆续有所报道,法国学者Schmidt(1981)报道了“自体游离结肠平滑肌片做人工肛门括约肌成形术”和德国学者Hoffmamm(1981)报道了“用肠管平滑肌重建肛门内括约肌手术”。我国学者在利用肠管重建内括约肌方面做了大量研究工作。
有人(1985)对25例患低们直肠癌患者,在行腹会阴联合切除术式时,采用“原位直肠套叠式人工肛门外”重建会阴部肛门,他在文献中写道:
在距切断之近端结肠断端上方5cm处,沿结肠纵轴行间断Lembert氏缝后一周,6~8周针,针距约3.5cm。使结肠形成一个自下而上的人工套叠,约套入2~2.5cm(图1)。将结肠无张力地托至会阴部,结肠残端膜剥除3厘米(图2),用“3/0”羊肠线与会阴部皮肤环形间断缝合,剩余之皮肤丝线间断缝合,原位人工肛门形成(图3)。将套叠环缝合于腹膜返摺以下固定,盆腔内放三腔滴流冲洗引流管,手术完成。
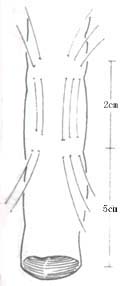
⑴结肠人工tinea套叠
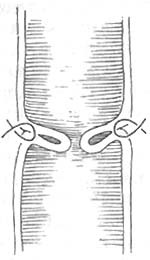
⑵套叠侧面
图1 套叠结肠
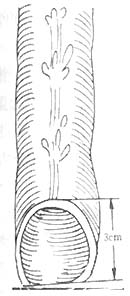
图2 剥除残端结肠粘膜
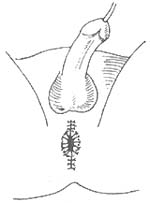
图3 原位人工肛门形成
这种术式形成的人工套叠现在普遍认为更多是直到一种机械性的阻挡作用,所以后来的被借鉴作为直肠瓣重建的方法。
Schmidt (1981)指出肛门内括约肌重建必须以下四个标准:①血流的重建;②神经的再生接通;③组织学无异常改变;④收缩力的保存。
3.会阴部结肠套叠式人工肛门外:我国在80年代肛门重建术发展进步非常快,尤其是在重建内括约肌的临床研究,与国外先进水平相比,几乎是同步进行,而且很有自己的特色。虽然结肠套叠重建内括约肌的术式存着一些不尽人意之外,但是这种术式的确是为临床拓展了一条新的思路。
我国学者席忠义1975年首先设计结肠残端腹壁套叠式人工肛门术,即对Miles手术的腹壁造口施行一定长度的结肠残端套叠式缝合,造成结肠末端不全梗阻,从而阻挡结肠内粪便直接外流,使结肠充分吸收水分,粪便成形,以期制约排便,达到不用肛门袋的目的。通过对50例该手术患者的临床观察,效果良好。在这一实践的提示下,会模拟内括肌形态,自1981年将“结肠残端腹壁套叠式人工肛门”用于会阴部,设计了会阴部结肠套叠式人工肛门重建术。他认为结肠残端套叠不有如下作用:①在结肠残端进行宽2.5~3cm的套叠式缝合,是模拟内括约肌形态,人为地制造结肠残端增厚的平滑肌,起到人造内括约肌的作用。同时又可导致结肠末端环状狭窄,不全梗阻,可直到平时闭合人工肛门,阻挡肠内容物直接外流,增加对水分重吸收的作用。据文献报道,耻骨直肠肌及肛直角,对粪便下降有机械屏障作用。以此论点,他将结肠套叠段的前上缘缝合固定于会阴体,使套叠环出口形成向上弯曲的角度,其后下缘固定于尾骨尖重建肛直角,同是城距套叠环前级5cm处即盆腔原膀胱(子宫)腹膜返折处的结肠前壁上,再行轴向折叠3cm横宽2cm,使该区肠壁前曲成角,肠腔内形成人工直肠瓣,以期在套叠环区造成一个较强的阻力,协助自控,定时排便。②拉到盆腔会阴部的乙状结肠平时具有自身作用并未受到影响,此结肠随时间的推移可形成直肠的功能。由于套叠环、肛直角和人工直肠瓣的存在,可使结肠形成的粪便,在肠内容物增多时产生一定的压力使肠蠕动加强压迫结肠内的神经感受器产生便意。对术后6~12个月人工肛门静息压可达3.72kPa,接近正常范围(4.21kPa)。据50例经人代肛门进入中等稠度钡剂立位造影,可见套叠环以上钡剂滞留,结肠呈直肠壶腹样扩张。灌钡后至排出时间最长40分钟,最短13分钟,说明套叠环的机械作用对控制排便是肯定的。
有学者通过研究后认为:结肠套叠式人工肛门,操作简单,在一定程度上能控制排便,但套叠环不具备括约肌能力,其作用主要通过套叠造成不全梗阻,阻挡肠内容物直接外流,增加结肠对水分再吸收,当形成粪便增多时,使肠腔内压增高,产生便意。若不注意手术细节,还可出现狭窄、梗阻及坏死等并发症。所以对该术式还应加强基础方面研究,加强远期效果观察。
有人(1986)在此基础上进行了随访,近期效果满意,肛门功能优良率达94.12%。他同时观察到随着时间推移,便意感染来越越明显。认为结肠自盆腔拖出,肠壁组织内可能逐渐建立直肠型感觉,当结甩充胀,压迫其临近盆壁组织的感受器,反射形成,建立新的肛门自制。Wald(1984)在研究病理情况下,直肠感觉传入通路遇到破坏时,机体能起用邻近的神经元来传志肛管直肠的感觉。
4.肠折叠股薄肌成表术:有人(1987)设计了在肠折叠的基础上,同时移植股薄肌重建外括约肌的术式,用以弥补肠管套叠所形成的括约肌功能不全的问题。其方法是:在上段6cm处做2.5cm肠折叠。于右股内侧沿薄肌直行纵切三处切口游离股薄肌到上点切断,注意勿损股薄肌的神经及血管。将股薄肌从皮下通道拉入会阴切口内,在肠折叠下绕肠一圈,于左耻骨结节处切开皮肤,将股薄肌绕肠一圈之后,将会阴皮下组织缝合固定在肠管上。
5.带蒂臀大肌重建肛管括约肌术式;在本世纪初30年代,Chintendern就率先采取臀大肌重建会阴部肛门。因为臀大肌肌束粗大,收缩力强所以有不少学者开展这类手术。在我国,这种手术开展较晚。有人(1986)首先报道了该手术。其方法是:
⑴第一期
第一步:在连续硬膜下麻醉下,取膀胱截石位,按腹会阴联合切除术要求常规根治癌肿。
第二步:在坐骨结节上3cm,股骨大粗隆下3cm,向股外侧肌中下1/3处作“L”形切口,(图4),切开皮肤皮下组织暴露臀大肌骨腹,在臀大肌骨腹下分离约4cm宽的臀大肌肌束远端到臀大肌下端附着于股骨臀肌粗隆处,即在臀大肌止点处,与此肌相邻的部分股外侧肌长约20cm。切断股外侧肌远端,然后向近心端分离股外侧股肌束与臀大肌……将游离臀大肌和股外侧肌通过皮下隧道引至会阴部切口备用,代括约肌。
图4 切口示意图
第三步:取膀胱截石位,按逆时针方向将臀大肌肌瓣环绕结肠下端一圈(图5),肛管口通过一食指之紧张度为适宜,然后将臀大肌瓣固定缝合于坐骨结节骨膜及残剩提肛肌边缘。
图5 臀大肌瓣环线结肠下端
⑵第二期:肛管成形术。第一期手术后2~3周会阴部创面基本愈合即可进行第二期手术。取膀胱截石位,切除脱出于皮面外多余结肠段,并分别在结肠造口两侧3点和9点处作一尖端向上“△”形切口,然后相对应的肛缘皮肤作一弧形向上的“△”形皮前,将此皮瓣之尖插入结肠“△”形之尖端,使形成新的肛管结肠粘膜,部分为转移皮瓣之皮肤。
虽然臀大肌收缩力较强,但由于臀大肌属横纹肌,易疲劳,所以持续收缩时间较短,因此该术式与其他单纯利用横纹肌重建会阴部术式一样存在着污粪,对稀便控制能力差等不足。
针对这些情况,有人(1988)报道了束臀大肌肌瓣局部移植加结肠套叠的术式,游正中(1988)报道了结肠末端去粘膜,翻转重建内括肌加臀大肌成形重建括约肌的术式,取得良好效果。
6.回结肠臀大肌移植术:为了改进单纯臀大肌移植再造的肛门对稀便控制不佳的不足,有人(1988)设计了回肠段及臀大肌移植重建直肠、肛管括约肌术:暴露右侧腹部,先探查移植回肠段的血管分布情况,切开升结肠外侧和盲肠下部腹膜,游离回肠末端、盲肠和升结肠,由会阴组配合用一布带从会阴部切口皮下2.5cm处,顺其骶前弯曲量至骶骨角,一般15~20cm,此即所须移植肠段长度(所需肠段长度应根据血管蒂的长度计算)。在阻断血管期间,可先行阑尾切除,继而施行回肠远端与降结肠断端、回肠近期端与升结肠远断吻合(图6),游离两侧臀大肌,长6cm、直径4~5cm各一束,每束肌肉再分成两束(图7),(图8)于原位于下交叉后围绕下拉的肠管与对侧交叉的肌肉缝合,其松紧度能容纳一食指(过紧影响肠管血液循环,过松影响术后功能)即可(图9)。将肠管断端全层与会阴皮下组织间隙缝合,剩余皮肤间断缝合,原位重建人工肛门即形成(图10)。
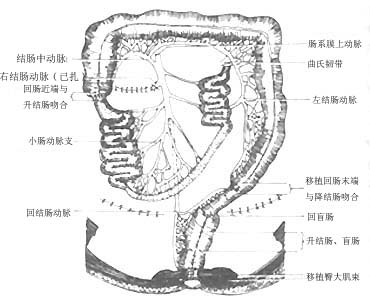
图6 回结肠段移植及回肠近端与升结肠吻合回肠远端与降结肠吻合示意图
图7 暴露臀大肌内侧部虚线表示取肌瓣的切线
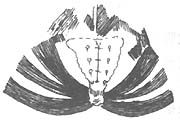
图8 两侧游离臀大肌瓣再各分成两束备用
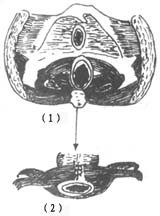
图9 两则展大肌原位交叉后缝合
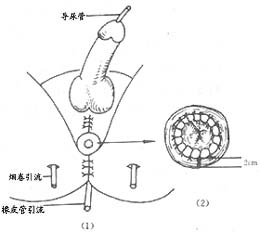
图10 原位重建肛门形成
⑴会阴部手术全部完成后示意图 ⑵重建肛门口缝合示意图,2cm示重建肛门完成后,肠粘膜与重建肛门外缘之距离
目前这种手术开展得不多,所以该术式的死亡率、肠管的存活情况以及肛门功能有待进一步观察。
7.新直肠角90度术式:我国学者不仅从内、外括约肌的重建,对肛门重建术进行了探讨,而且对肛直角的重建做了大量的研究工作。有人(1986)报道了“新直肠角”和用结肠浆肌层外翻卷建造内括约肌的术式,对35例患者进行了治疗。他在文献中记叙到:①按照Miles术式,切除全部直肠,乙状结肠及肛门周围组织和内外括约肌。②“新直肠角”建造:距结肠残端12cm处在结肠系膜对侧缘将结肠远、近段横向间断浆肌层缝合7~9针,使远端结肠向前与近端结肠成90º内角,成为“新直肠角”。③内括约肌重建:将结肠残端粘膜剥除5cm,并将其向上翻卷套在结肠壁上,再用细丝线与结肠壁作浆肌层间断缝合一周。缝合后的肠下段约3cm成双层结肠壁,建成人工内括约肌(图11)。④会阴部人工肛门:将结肠下端从会阴部切口拖出,“新直肠角”的内角向前,用丝线将“新直肠角”部以上结肠紧靠骶前与盆底周围组织缝合固定数针,再把“新直肠角”以下结肠前壁在距下端2cm左右与周围组织缝合固定数针,使“新直肠角”能够保持在良好的向前90º内角的位置。再将结肠缘在会阴部原肛门切除区紧靠前侧与皮肤用丝线间断缝合周重建肛门,使人工肛门可容纳1指,盆底放置乳胶管一根从切口旁引出固定作引流。
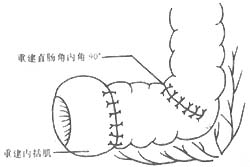
图11 重建直肠角及内括约肌
有学者指出,该术式所重建新直肠角因与正常生理结构有悖,所以功能将不稳定,所以无法直到真正的肛直角的作用。正如众所周知,肛直肠角是综合体现盆底肌肉功能的特殊肠管形态特征,只有在盆底肌肉功能正常的基础上,这种特殊形态特征才具有排便自制过程中诸如“阀门”之类的功能。作者自己观察到“瓣直肠角”以上的肠管有扩大现象,所以这种术式更主要是通过提高“新直肠”的顺应性来性病重建肛门的功能。
8.模拟正常排便生理解剖结构重建会阴部肛门术式:有人(1988)提出在同时重建内、外括约肌的基础上,纵行修补残存肛提肌重建肛直角。同时重建直肠横襞,以完善再造肛门的功能。本术式术中行肠腔大剂量化疗药灌注后,在Miles手术的基础上,按直肠肛管的解剖生理进行模拟设计。
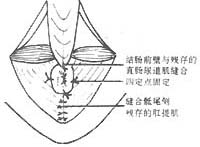
⑴重建肛管直肠角:从骶尾侧开始,缝合残存的提肛肌,使结肠从腹侧裂隙通过,并将结肠与修补的提肛肌裂隙作四定点缝合固定,前面一针与残存直肠尿道肌缝合,结肠性直肠末端与残存肛尾韧带缝合,形成新的肛管直肠角(图12)。
⑴
⑵
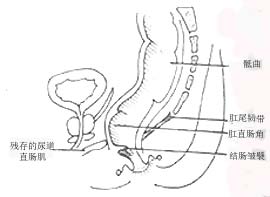
图12 重建肛管直肠角
⑵重建内括约肌:将结肠末端粘膜剥脱6~8cm,浆肌层袖状向上翻卷再向下套叠,使三层结肠肌层合为一层,其宽度3~4cm,套叠层上下缘合缘合数针(图13)。
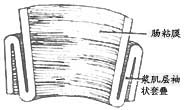
图13 重建内括约肌
⑶重建外括约肌:游离右侧股薄肌,于该肌远端止点切断,注意勿损伤近端的血管神经,将游离的股薄肌从皮下通道拉至会阴切口内,顺时针围围绕结肠一圈,在结肠前交叉,远端肌腿固定于对侧耻骨结节韧带上,重建之肛门以通过一食指感有张力为宜(图14)。
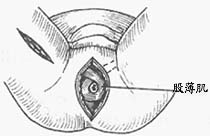
图14 重建后肛门(容一食指)
⑷重建直肠瓣及骶曲:距结肠末端4~8cm处,一左一右分别缝合3~4针,形成两个结肠皱壁,肠管放置骶骨前,并与骶前结缔组织缝合固定,使重新形成骶曲(图12)。
该术式同时重建内外括约肌,这样既恢复了自主抑制作用,又恢复了随意抑制功能,完善了重建肛门对排便的机械抑制作用。在此基础上修补残存肛提肌以期修复排便感觉中心。设计方法是先进的,临床效果也较好。但目前应加强神经生理学及电生理学等方面的基础研究,为手术是否达到临床设计要求提供客观依据。
|




